Czy leczenie rdzeniowego zaniku mięśni komórkami macierzystymi jest skuteczne?
Czy rozważasz leczenie rdzeniowego zaniku mięśni komórkami macierzystymi?
Rdzeniowy zanik mięśni (SMA) to schorzenie neurorozwojowe wpływające na funkcjonowanie mięśni i mobilność wielu dzieci, które ma ograniczone możliwości leczenia, a większość z nich koncentruje się jedynie na łagodzeniu obecnych objawów i zwiększaniu długości życia i jakości życia takich osób. Leczenie komórkami macierzystymi daje jednak nadzieję, a badania pokazują, że terapia komórkami macierzystymi może spowolnić lub odwrócić podstawowe objawy SMA.
Czytaj dalej, aby dowiedzieć się, czy leczenie komórkami macierzystymi rdzeniowego zaniku mięśni może być dla Ciebie odpowiednie.
Jak działa leczenie SMA komórkami macierzystymi?
Poprzez uwalnianie substancji takich jak czynniki wzrostu, cytokiny i pęcherzyki zewnątrzkomórkowe, mezenchymalne komórki macierzyste (MSC) inicjują gojenie tkanek, dostosowują zachowanie układu odpornościowego i ułatwiają odnowę tkanek, jednocześnie łagodząc stany zapalne.
W kontekście leczenia rdzeniowego zaniku mięśni (SMA) odkryto, że MSC mogą pobudzać odradzanie się uszkodzonych neuronów ruchowych i zwiększać wydajność mięśni. Poza tym mają one zdolność do łagodzenia stanów zapalnych i wzmacniania odpowiedzi immunologicznej, zapewniając tym samym dalszą pomoc w regeneracji uszkodzonych tkanek. Biorąc wszystko pod uwagę, terapia komórkami macierzystymi staje się obiecującym, bezpiecznym i skutecznym podejściem terapeutycznym dla osób cierpiących na SMA.
Jak terapia komórkami macierzystymi łagodzi objawy rdzeniowego zaniku mięśni?
Komórki macierzyste to komórki, które są „pluripotencjalne”, co oznacza, że mogą różnicować się we wszystkie inne komórki ze względu na ich zdolność do samoodnawiania. Mogą one przekształcić się w komórki ektodermalne (np. skóra i niektóre struktury neurologiczne), mezodermalne (np. kości, chrząstki i komórki krwi) lub endodermalne (np. komórki narządów wewnętrznych).
Dlatego wstrzyknięcie komórek macierzystych – od dawcy z prawidłowym genem SMN – powinno teoretycznie umożliwić im różnicowanie i „zastąpienie” uszkodzonych neuronów i białek neuronów, wadliwych z powodu nieprawidłowości genetycznych prowadzących do SMA (6). Pomimo mniejszej liczby pacjentów przebadanych w literaturze ze względu na rzadkość choroby, terapia komórkami macierzystymi okazała się dość obiecująca w przypadku SMA. Dała ona nową nadzieję na wyleczenie lub przynajmniej złagodzenie i opóźnienie objawów SMA w celu poprawy jakości życia.
Po przetestowaniu leczenia komórkami macierzystymi u osób z SMA, oprócz ich zdolności do samoodnawiania, udowodniono, że komórki macierzyste mają dodatkowe korzyści inne niż zastępowanie tkanek; w tym (7-9):
- Wymiana i naprawa uszkodzonych neuronów: Jak wspomniano, jest to ich pierwotna funkcja; zastąpienie uszkodzonej tkanki – tj. neuronów w przypadku SMA – poprzez konwersję jednego typu komórek na inny. Komórki te mogą zatem mieć normalne białka, aby normalnie funkcjonować.
- Zwiększenie produkcji czynników neurotroficznych, które promują proliferację i różnicowanie komórek nerwowych (np. czynnik neurotroficzny pochodzenia glejowego (GDNF) i czynnik neurotroficzny pochodzenia mózgowego (BDNF)). Czynniki te mogą lokalnie zwiększać rekrutację, proliferację i dojrzewanie komórek w uszkodzonych lub dotkniętych chorobą neuronach rdzenia kręgowego.
- Modulowanie układu odpornościowego i trwającego procesu zapalnego: Zmniejszając w ten sposób neurodestrukcyjny i zanikowy proces powodujący charakterystyczne objawy SMA.
- Promowanie dopływu krwi do układu nerwowego: Stymulowanie tworzenia nowych naczyń krwionośnych (neowaskularyzacja/angiogeneza) poprzez pobudzanie różnych czynników wzrostu stymulujących naczynia krwionośne (np. VEGF).
- Zapobieganie śmierci neuronów: Poprzez hamowanie procesu apoptozy, czyli zaprogramowanej śmierci komórek, dotkniętych neuronów do czasu ich odpowiedniej naprawy.
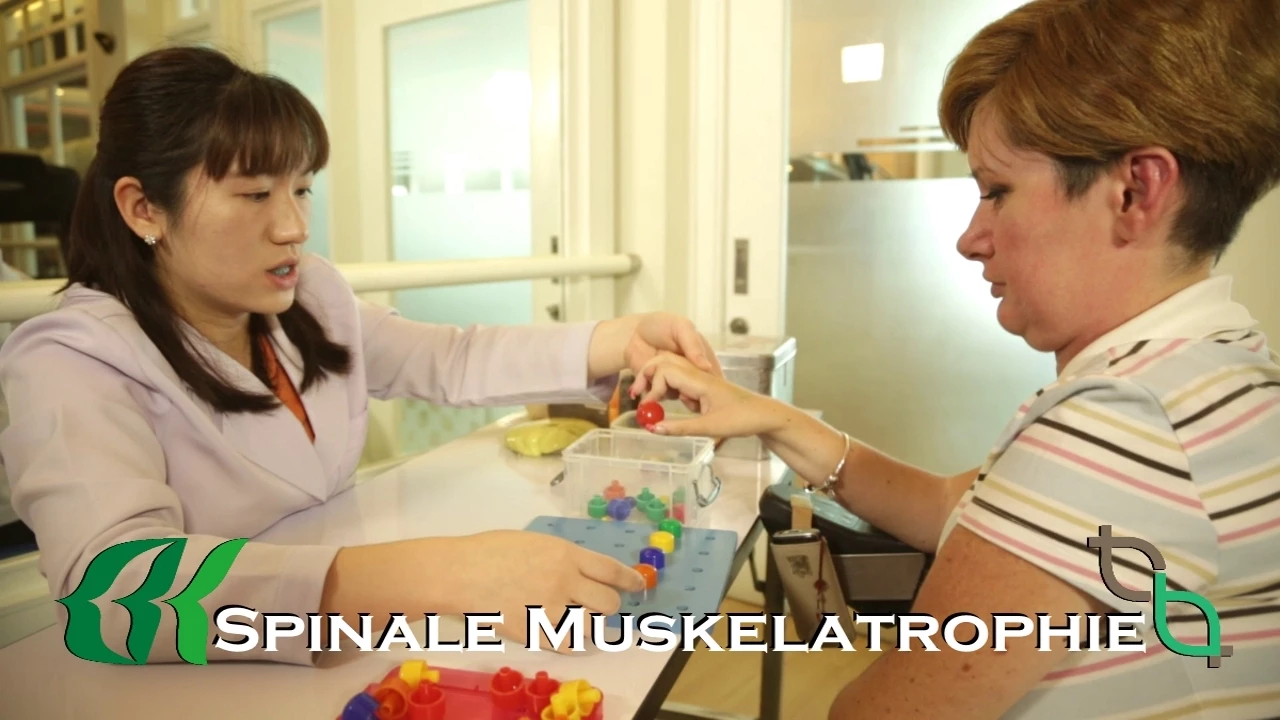
Agnieszka Filipkowska czuła, że leczenie komórkami macierzystymi jest jej ostatnią szansą na życie. Mając wrodzone SMA, stan jej mięśni pogarszał się, a każdy rok czulą się słabsza. Inna Medycyna i programy z Europy nie pomogli Agnieszce, więc postanowiła spróbować leczenie za pomocą komórek macierzystych Beike. Teraz, czuje się dużo silniejsza i ma więcej energii dzięki połączeniu komórek macierzystych i medycyny funkcjonalnej.
Potencjalna poprawa po leczeniu SMA komórkami macierzystymi
Celem naszego leczenia rdzeniowego zaniku mięśni jest wspieranie gojenia się urazu w rdzeniu kręgowym w celu przywrócenia funkcji neurologicznych. W związku z tym po naszych zabiegach możliwa jest różnego rodzaju poprawa, a nasi dotychczasowi pacjenci doświadczyli tego, co następuje*:
- Poprawiony zakres ruchów
- Zwiększona siła mięśni
- Zwiększona masa mięśniowa
- Poprawiony balans
- Lepsza koordynacja
- Poprawa rozwoju
- Zmniejszona sztywność mięśni
*Należy pamiętać, że jak w przypadku każdego leczenia, nie można zagwarantować poprawy. Skontaktuj się z nami, aby uzyskać więcej informacji na temat możliwej poprawy w konkretnym przypadku.
Leczenie
Od 2005 roku rozwijamy i optymalizujemy nasze protokoły leczenia komórkami macierzystymi dla różnych schorzeń. Wierzymy, że tylko kompleksowe rozwiązanie terapeutyczne może pozwolić naszym pacjentom na prawdziwe korzyści z komórek macierzystych. Dlatego oprócz dostarczania dużych ilości komórek macierzystych, aby zmaksymalizować potencjał regeneracyjny każdego pacjenta, uważamy również, że konieczne jest towarzyszenie leczeniu rozbudowanym i codziennym programem terapeutycznym, aby stymulować odpowiedź regeneracyjną.
Nasze leczenie komórkami macierzystymi Rdzeniowego Zaniku Mięśni (SMA) składa się z 4 do 8 prostych i minimalnie inwazyjnych wstrzyknięć komórek macierzystych pochodzących z pępowiny. Komórki macierzyste przeszczepiane są dwiema odrębnymi metodami: drogą dożylną przy użyciu standardowego systemu kroplówek oraz poprzez iniekcję śródszpikową wykonywaną po nakłuciu lędźwiowym. Te dwie metody podawania pozwalają na zwiększenie skuteczności przy jednoczesnym zapewnieniu bezpieczeństwa i minimalnych niedogodności dla pacjenta.
- Pobyt od 15 do 23 dni
- Zastrzyki dożylne i śródszpikowe
- Komórki UCBSC / UCMSC
- Codzienny program terapeutyczny
- 120-400 milionów komórek
- Program żywieniowy
Historie doświadczeń pacjentów
Dowiedz się więcej o pacjentach wcześniej leczonych protokołami komórek macierzystych Beike. Rodziny uczestniczące w tych wpisach na blogu opowiadają o swoich historiach i przedstawiają własne spojrzenie na leczenie, w tym przemyślenia dotyczące codziennych terapii, samego wstrzyknięcia komórek macierzystych, a także poprawy zauważonej podczas i po leczeniu.
Jakość i ilość komórek macierzystych zapewniona

Różne rodzaje komórek macierzystych dla różnych potrzeb
Beike dostarcza komórki macierzyste z dwóch odrębnych źródeł: krwi pępowinowej i tkanki pępowinowej. Próbki związane z pępowiną są oddawane przez zdrowe matki po normalnych porodach i wysyłane do laboratoriów Beike Biotech w celu przetworzenia.
Po zapoznaniu się z pełną informacją medyczną pacjenta, nasi lekarze zalecą, które źródło komórek macierzystych powinno być wykorzystane w leczeniu. Nasze protokoły leczenia mogą obejmować jeden lub wiele rodzajów komórek macierzystych w połączeniu w zależności od konkretnego stanu każdego pacjenta.
Najwyższe międzynarodowe standardy przetwarzania komórek macierzystych
Beike Biotechnology przetwarza własne dorosłe komórki macierzyste w swoich laboratoriach o międzynarodowej akredytacji. Firma posiada pełną kontrolę nad procesem przetwarzania i kontroli jakości wszystkich produktów z komórek macierzystych, zapewniając doskonałe bezpieczeństwo i najwyższą jakość.

Filmy o pacjentach
Poniżej znajdują się wywiady wideo nagrane podczas leczenia komórkami macierzystymi Beike. Rodziny przedstawione w tych filmach opowiadają o swoich osobistych historiach i doświadczeniach z leczenia, w tym o zauważonej poprawie.
Poprawa wspomniana w tych filmach jest typowa, jednak nie gwarantuje, że u wszystkich pacjentów może wystąpić taka sama poprawa.
Dlaczego warto wybrać Beike na leczenie komórkami macierzystymi?
Doświadczenie: Z ponad dziesięcioletnią praktyką, masz pewność, że będziesz doradzany i leczony przez kompetentnych specjalistów.
Bezpieczeństwo: Wspierani przez akredytacje krajowych i międzynarodowych organów jesteśmy oddani dostarczaniu najwyższej możliwej jakości komórek macierzystych dla Twojej korzyści.
Różnorodność: Dostępnych jest wiele typów komórek macierzystych posiadających różne zdolności, aby dostosować się do specyficznego stanu każdego pacjenta. Nie stosujemy tego samego rodzaju komórek macierzystych u wszystkich pacjentów.
Ekstensywność: Codziennie dostarczany jest kompletny program terapii wspomagającej, aby stymulować świeżo przeszczepione komórki macierzyste pacjenta. Najlepszą poprawę można uzyskać tylko poprzez wspieranie swoich komórek macierzystych.
Wsparcie: Po leczeniu zapewniony jest pełny program kontrolny, w którym zostaniesz poproszony o wzięcie udziału w 1, 3, 6 i 12 miesiącu po leczeniu. Dostęp do naszego zespołu po zabiegu jest bardzo ważny, ponieważ możesz otrzymać dalsze porady, aby zmaksymalizować poprawę.

Założona w lipcu 2005 roku, Shenzhen Beike Biotechnology jest krajowym przedsiębiorstwem high-tech specjalizującym się w transformacji klinicznej i usługach technicznych technologii leczenia biologicznego strategicznych branż wschodzących.
Uzyskaj więcej informacji teraz
Terapia komórkami macierzystymi w rdzeniowym zaniku mięśni (SMA) - często zadawane pytania
- Jakie są możliwe skutki uboczne terapii komórkami macierzystymi w rdzeniowym zaniku mięśni?
Oczywiście żadne leczenie nie jest pozbawione powikłań, a terapia komórkami macierzystymi jest taka sama. Jednak pomimo swojej nowości, terapia komórkami macierzystymi ma ograniczone skutki uboczne, jeśli jest stosowana prawidłowo, z porównywalnymi ogólnymi skutkami ubocznymi do tych doświadczanych podczas regularnej transfuzji krwi lub przeszczepu narządów obcych (np. reakcje alergiczne, odrzucenie komórek lub gorączka).
Ponadto, w badaniach dotyczących terapii komórkami macierzystymi w SMA, nie zgłoszono żadnych rzeczywistych skutków ubocznych, biorąc pod uwagę już ciężki przebieg choroby u tych niemowląt przed rozpoczęciem terapii komórkami macierzystymi. Jednak w przypadku stosowania terapii komórkami macierzystymi w podobnych schorzeniach, żaden z wcześniej wspomnianych skutków ubocznych nie zagrażał życiu ani nie miał długotrwałych konsekwencji, a w momencie ich wystąpienia można je było łatwo kontrolować medycznie (11).
- Jakie czynniki mogą wpływać na powodzenie terapii komórkami macierzystymi w leczeniu rdzeniowego zaniku mięśni?
Podsumowaliśmy różne czynniki, które mogą wpływać na reakcję na terapię komórkami macierzystymi oraz sposób, w jaki Beike Technology odnosi się do każdego z nich, aby zapewnić najwyższą skuteczność przy użyciu możliwie najbezpieczniejszej procedury.
- Dawka/liczba komórek macierzystych: Im wyższa dawka komórek macierzystych – oczywiście w określonych granicach – tym lepsza odpowiedź. W Beike Technology podajemy optymalną dawkę około 120-400 milionów komórek (w zależności od wagi i wieku dziecka) w przypadku SMA.
- Droga/metoda podania: Badania wykazały, że połączenie iniekcji dokanałowej (poprzez nakłucie lędźwiowe bezpośrednio w płynie mózgowo-rdzeniowym) z tradycyjną drogą dożylną zapewnia lepszą odpowiedź niż podawanie samych zastrzyków dożylnych (co powoduje, że komórki macierzyste trafiają do innych narządów niż mózg, zanim dotrą do mózgu). Dlatego w Beike Technology stosujemy jednocześnie drogę dożylną i dokanałową, aby uzyskać maksymalną skuteczność, zapewniając jednocześnie jak najmniej skutków ubocznych lub toksyczności.
- Rodzaj użytych komórek macierzystych: Zarówno komórki macierzyste pochodzące ze sznura pępowiny, których używamy w Beike Technology, jak i komórki macierzyste szpiku kostnego mają lepiej udowodnioną skuteczność w SMA w porównaniu z innymi rodzajami komórek macierzystych.
- Czas przeszczepienia komórek macierzystych: Wczesna interwencja ma kluczowe znaczenie dla osób z SMA. Dlatego zalecamy wczesną interwencję wkrótce po postawieniu diagnozy, w zależności od rodzaju SMA u dziecka.
- Czas obserwacji: Znaczące korzyści z terapii komórkami macierzystymi u pacjentów z SMA zaczynają pojawiać się około 4 tygodni po terapii komórkami macierzystymi, a większość osób osiąga swój pełny potencjał około 3 miesięcy po leczeniu. W Beike Technology, nawet po wypisaniu pacjenta ze szpitala, zapewniamy pełny program obserwacji rozpoczynający się już po miesiącu i trwający do roku po przeszczepie. Masz pełny dostęp do naszego profesjonalnego zespołu nawet po opuszczeniu naszego centrum.
- Które komórki macierzyste są najlepsze w leczeniu rdzeniowego zaniku mięśni?
Do tej pory nie przeprowadzono ani jednego badania – zgodnie z naszą wiedzą – które porównywałoby różne typy komórek macierzystych pod względem bezpieczeństwa i skuteczności, szczególnie u pacjentów z SMA.
Obecnie dostępnych jest wiele rodzajów komórek macierzystych do wykorzystania w różnych schorzeniach, w tym embrionalne komórki macierzyste, mezenchymalne komórki macierzyste (np. szpik kostny i komórki macierzyste pępowiny), hematopoetyczne komórki macierzyste, neuronalne komórki macierzyste, a także wiele innych źródeł (6).
Jednakże, patrząc na inne podobne zaburzenia neurorozwojowe i różne próby terapii komórkami macierzystymi, najbardziej możliwymi do pozyskania i bezpiecznie stosowanymi komórkami macierzystymi, które były używane i testowane u osób z innymi schorzeniami neurologicznymi, są mezenchymalne komórki macierzyste, takie jak te uzyskane z próbek pochodzących z pępowiny, zarówno krwi pępowinowej, jak i tkanki pępowinowej, lub komórek macierzystych szpiku kostnego. Te dwa typy zapewniają najlepsze wyniki w schorzeniach neurologicznych, ponieważ łatwo przekraczają barierę krew-mózg, docierając do mózgu i rdzenia kręgowego oraz mają najmniejsze możliwe skutki uboczne (7).
Obecnie prowadzone są również badania nad wykorzystaniem genetycznie zmodyfikowanych komórek macierzystych, które można pozyskać od pacjentów z SMA, aby umożliwić samodzielne wstrzyknięcie komórek macierzystych, które zostały zmodyfikowane tak, aby zawierały normalne białko SMN. Komórki te znane są jako indukowane pluripotencjalne komórki macierzyste (iPSC). Celem tej techniki jest zapobieganie możliwym skutkom ubocznym lub reakcjom alergicznym spowodowanym przeszczepieniem „obcych” komórek od dawców innych niż sami pacjenci. Jednak technika ta nadal nie ma zastosowania klinicznego w medycynie (8).
Dlatego też nasza praca opiera się obecnie na jednym z jedynych badań klinicznych testujących terapię komórkami macierzystymi u pacjentów z SMA, w którym stwierdzono, że terapia mezenchymalnymi komórkami macierzystymi przyniosła widoczne korzyści, gdy była podawana dwiema równoczesnymi drogami podawania; zarówno dożylnie, jak i dokanałowo; w porównaniu z sytuacją, gdy stosowano pojedynczą drogę dokanałową (10).
Wyniki te przyczyniły się do ustanowienia naszej obecnej metody podawania komórek macierzystych podwójnego typu.
- Jakich komórek macierzystych używamy w leczeniu rdzeniowego zaniku mięśni?
W Beike Technology używamy komórek macierzystych pochodzących z pępowiny do leczenia SMA, zarówno mezenchymalnych/tkankowych związanych z pępowiną, jak i komórek krwiotwórczych pobranych od zdrowych matek po normalnym porodzie. Jak wspomniano wcześniej, jednoczesne podawanie obu rodzajów komórek macierzystych zapewnia lepsze wyniki.
- Jakie są objawy rdzeniowego zaniku mięśni?
Jak wspomniano wcześniej, SMA ma szeroki zakres nasilenia objawów i nie wszystkie objawy mogą występować w tym samym czasie lub z takim samym nasileniem. Typowe objawy SMA obejmują (2):
Osłabienie mięśni: W zależności od podtypu SMA, osłabienie to może wahać się od łagodnego osłabienia zdiagnozowanego w wieku dorosłym (typ 4) do ciężkiego wyniszczającego uogólnionego osłabienia mięśni upośledzającego rozwój noworodka (typ 1). Niemowlęta z ciężką postacią SMA zazwyczaj mają:
- Trudności z połykaniem i ssaniem podczas karmienia piersią
- Trudności z utrzymaniem głowy
- Trudności z siedzeniem
- Trudności z osiągnięciem normalnych etapów rozwoju
W niektórych łagodniejszych/średnich postaciach SMA niemowlęta mogą być w stanie normalnie siedzieć, ale mogą nie być w stanie chodzić.
- Zanik mięśni: Zanik mięśni definiuje się jako zanik mięśni lub zmniejszenie masy mięśniowej z powodu długotrwałego braku unerwienia i ruchu. Proces atrofii nasila się wraz z wiekiem, im dłuższy jest okres braku unerwienia i ruchu.
- Zmniejszone napięcie mięśniowe (hipotonia)
- Problemy z oddychaniem: Występują w ciężkich podtypach SMA z powodu osłabienia mięśni oddechowych. U niemowląt z ciężką postacią SMA może wystąpić aspiracja, zapadnięcie się płuc, a w rezultacie nawracające infekcje dróg oddechowych. U niektórych dzieci może dojść do niewydolności oddechowej w wyniku osłabienia układu oddechowego.
- Skrócona długość życia: W przypadku osób dotkniętych poważniejszymi typami choroby, zwłaszcza typu 1, długość życia tych pacjentów jest niestety ograniczona.
- Kiedy jest optymalny czas na terapię komórkami macierzystymi w przypadku rdzeniowego zaniku mięśni?
Jednym z problemów obserwowanych w przypadku SMA jest to, że jego okno możliwości jest dość krótkie, szczególnie u niemowląt z SMA typu 1. Okres ten nie jest dokładnie znany; jednak w pewnym momencie, nawet jeśli interweniujemy za pomocą terapii komórkami macierzystymi, korzyści kliniczne mogą nie być optymalne – lub mogą być tymczasowe do czasu trwania zastrzyków z komórek macierzystych. Zostało to zasugerowane w jednym z badań, w którym zauważono, że korzyści zaobserwowane u pacjentów z SMA typu 1 – którzy wszyscy mieli więcej niż 7 miesięcy – były tymczasowe, mimo że wykazywali znaczną poprawę w okresie terapii.
W związku z tym doradzili, że rozwiązaniem może być wcześniejsza terapia komórkami macierzystymi, zanim dojdzie do trwałego uszkodzenia neuronów u dzieci z SMA. Oczywiście to okno terapeutyczne różni się w zależności od podtypu SMA u dziecka i nasilenia jego objawów, a powodem, dla którego większość badań przeprowadzonych na pacjentach z SMA wykazała częściowe korzyści, może być fakt, że rekrutowano do nich starsze niemowlęta z cięższym typem 1 SMA, u których prawdopodobnie doszło do trwałego uszkodzenia neuronów ze względu na ich starszy wiek (9, 10).
W związku z tym dla osób z SMA typu 1 optymalnym okresem leczenia może być wiek od 4 do 6 miesięcy.
Osoby z mniej poważnymi postaciami mogą jednak odnosić korzyści długo po tym okresie, w zależności od nasilenia objawów. Dlatego zalecamy konsultację z naszymi specjalistami przed rozpoczęciem leczenia w celu oszacowania stopnia korzyści, jakie można uzyskać dzięki terapii komórkami macierzystymi.
Ogólnie można powiedzieć, że im wcześniej rozpocznie się terapię komórkami macierzystymi, tym lepsze są oczekiwane rezultaty.
- Jakie są aktualne metody leczenia rdzeniowego zaniku mięśni?
Pomimo wielu postępów mających na celu wcześniejsze poznanie dokładnego mechanizmu genetycznego odpowiedzialnego za SMA, aby umożliwić szybkie leczenie i zapewnić lepszą jakość życia dzieciom i dorosłym żyjącym z tak wyniszczającą chorobą, nie poczyniono większych postępów w leczeniu jej pierwotnej przyczyny – tj. nieprawidłowych białek nerwowych. Obecne metody leczenia mają na celu jedynie złagodzenie lub zapobieganie możliwym powikłaniom związanym z osłabieniem mięśni, takim jak (1, 3):
Wsparcie płucne/oddechowe: Te środki wsparcia obejmują edukację rodziców na temat przebiegu choroby i jej możliwych powikłań oraz wczesne przewidywanie objawów oddechowych, aby zapobiec ich progresji. Takie środki obejmują rutynowe szczepienia przeciwko powszechnym infekcjom dróg oddechowych i naukę, jak prawidłowo pomagać dzieciom podczas kaszlu, aby zapobiec ich aspiracji lub infekcjom. Wentylacja mechaniczna może być konieczna u osób z ciężkimi objawami i częstymi infekcjami.
Wsparcie żywieniowe: Wiąże się to z podawaniem dzieciom z trudnościami w połykaniu i/lub karmieniu diet półstałych w celu zrekompensowania braku odpowiedniego żucia i problemów żołądkowo-jelitowych. Niektóre dzieci z poważnymi trudnościami żywieniowymi mogą wymagać założenia gastrostomii (zewnętrznego otworu w żołądku w celu bezpośredniego karmienia).
Wsparcie ruchowe: Obejmuje to wielodyscyplinarne leczenie mające na celu poprawę jakości życia osób z SMA i umożliwienie im pełnego wykorzystania ich potencjału oraz utrzymania pewnego poziomu niezależności. Niektóre przykłady obejmują korzystanie z urządzeń wspomagających chodzenie/ruch, takich jak wózki inwalidzkie i pionizatory. Fizjoterapia i terapia wodna oraz trening pływacki mogą być również stosowane w celu poprawy wytrzymałości mięśni. U niektórych pacjentów z powiązanymi deformacjami pozycji (np. skoliozą lub bocznym skrzywieniem kręgosłupa), mogą oni odnieść korzyści z ortopedycznej korekcji chirurgicznej deformacji, aby umożliwić lepszą postawę i zakres ruchu.
Terapia genowa: Jest to nowatorska forma terapii, która polega na dożylnym lub doustnym podawaniu „genetycznie zmodyfikowanej” funkcjonalnej formy genu SMN – który jest pierwotnie wadliwym genem w SMA. Leczenie to jest jednak nadal nowatorskie i dość kosztowne; niektóre dostępne na rynku leki wymagają corocznych – lub nawet częstszych – zastrzyków przez całe życie, aby utrzymać uzyskane korzyści. Do tej pory stanowi to poważne obciążenie finansowe dla większości osób, ponieważ nie wszystkie kraje pokrywają jego stosowanie w ramach polis ubezpieczeniowych; a nawet jeśli czasami jest on objęty ubezpieczeniem, zwykle wiąże się to ze ścisłymi wytycznymi dotyczącymi włączenia, ograniczającymi jego stosowanie u wielu niemowląt z SMA. Innym problemem związanym z tym leczeniem jest to, że nie wszyscy pacjenci z SMA kwalifikują się do jego otrzymania i że może ono wiązać się z pewnymi skutkami ubocznymi, w tym podwyższonym poziomem enzymów wątrobowych i supresją szpiku kostnego u wielu leczonych osób – co może stanowić problem, gdy jest stosowane u tak młodych pacjentów (4, 5).
Jak widać, wszystkie te terapie mają charakter wyłącznie wspomagający lub rehabilitacyjny, a nawet nowo wyprodukowane formy terapii genowej wciąż mają przed sobą długą drogę, zanim staną się łatwiej dostępne dla społeczeństwa i zanim uzyskają lepsze dane dotyczące ich długoterminowej skuteczności, a także profilu skutków ubocznych.
- Co to jest rdzeniowy zanik mięśni?
Rdzeniowy zanik mięśni to dziedziczne zaburzenie neurologiczne charakteryzujące się utratą neuronów ruchowych unerwiających różne mięśnie ciała. Pomimo tego, że jest to rzadkie zaburzenie, dotykające około jednego niemowlęcia na co najmniej 10 000 żywych urodzeń, nadal jest jedną z głównych dziedzicznych przyczyn niepełnosprawności i śmierci niemowląt. Zaburzenie to ma szeroki zakres podtypów i nasilenia objawów.
Najczęstsza postać SMA, znana jako SMA typu 1, stanowi ponad połowę przypadków i jest to ciężka postać SMA, która jest dziedziczona autosomalnie recesywnie. Rdzeniowy zanik mięśni występuje głównie z powodu nieprawidłowości genetycznej w genie SMN kodującym białka odpowiedzialne za prawidłowe funkcjonowanie nerwów. Ta nieprawidłowość białkowa wpływa na neurony ruchowe – tj. nerwy zaopatrujące mięśnie w porównaniu z nerwami czuciowymi – powodując cechy charakterystyczne dla SMA (1-3).
Referencje
1. Arnold WD, Kassar D, Kissel JT. Rdzeniowy zanik mięśni: diagnostyka i postępowanie w nowej erze terapeutycznej. Muscle & nerve. 2015;51(2):157-67. Dostępne na stronie: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4293319/
2. Kolb SJ, Kissel JT. Rdzeniowy zanik mięśni. Neurologic clinics. 2015;33(4):831-46. Dostępne na stronie: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4628728/
3. Van Alstyne M, Pellizzoni L. Postępy w modelowaniu i leczeniu rdzeniowego zaniku mięśni. Curr Opin Neurol. 2016;29(5):549-56. Dostępne na stronie: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5074385/
4. Aslesh T, Yokota T. Przywracanie ekspresji SMN: An Overview of the Therapeutic Developments for the Treatment of Spinal Muscular Atrophy. Cells. 2022;11(3). Dostępne na stronie: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8834523/
5. Yang D, Ruan Y, Chen Y. Bezpieczeństwo i skuteczność terapii genowej onasemnogenem abeparvovec w leczeniu rdzeniowego zaniku mięśni: Przegląd systematyczny i metaanaliza. Journal of Paediatrics and Child Health. 2023;59(3):431-8. Dostępne na stronie: https://pubmed.ncbi.nlm.nih.gov/36722610/
6. Ebert AD, Svendsen CN. Model rdzeniowego zaniku mięśni z wykorzystaniem komórek macierzystych. Archives of neurology. 2010;67(6):665-9. Dostępne na stronie: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3140872/.
7. Paradisi M, Alviano F, Pirondi S, Lanzoni G, Fernandez M, Lizzo G, et al. Human mesenchymal stem cells produce bioactive neurotrophic factors: source, individual variability and differentiation issues. International journal of immunopathology and pharmacology. 2014;27(3):391-402. Available from: https://journals.sagepub.com/doi/10.1177/039463201402700309
8. Han F, Ebrahimi-Barough S, Abolghasemi R, Ai J, Liu Y. Terapia komórkowa rdzeniowego zaniku mięśni. Postępy w medycynie eksperymentalnej i biologii. 2020;1266:117-25. Dostępne od:
9. Andolina M. Leczenie rdzeniowego zaniku mięśni za pomocą dokanałowych komórek mezenchymalnych. International journal of stem cells. 2012;5(1):73-5. Dostępne na stronie: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3840989/
10. Villanova M, Bach JR. Wyniki allogenicznej terapii mezenchymalnymi komórkami macierzystymi u trzech pacjentów z rdzeniowym zanikiem mięśni typu 1. American journal of physical medicine & rehabilitation. 2015;94(5):410-5. Dostępne na stronie: https://europepmc.org/article/med/25882135
11. Qu J, Zhou L, Zhang H, Han D, Luo Y, Chen J, et al. Skuteczność i bezpieczeństwo terapii komórkami macierzystymi w porażeniu mózgowym: Przegląd systematyczny i metaanaliza. Granice w bioinżynierii i biotechnologii. 2022;10:1006845. Dostępne na stronie: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9794999/